miércoles, 22 de julio de 2009
Cuestonario
1.- ¿Que es el agua?
El agua es el liquido más común de la superficie de la superficie terrestre, también es el principal componente en peso de todos los seres vivos (aproximadamente el 70% de su peso total); ya que el agua es el componente más abundante de la célula.
2.- Describa la molécula del agua
La estructura de la molécula de agua esta formada por 2 átomos de hidrogeno y un átomo de oxígeno que se mantienen unidos por enlaces covalentes (se forma cuando 2 átomos comparten electrones, el cual es un enlace muy fuerte)
3.- Mencione las propiedades químicas del agua
• Calor específico: el agua contribuye a estabilizar la temperatura del organismo en función de su elevado calor específico.
• Cohesión: fuerza implicada en mantener la unión de moléculas de la misma sustancia.
• Tensión superficial: resistencia a la penetración de la superficie de un líquido causado por la cohesión de sus moléculas (como por ejemplo el mercurio). Ayuda para el transporte del agua.
• Conductividad térmica: el agua influye en la termorregulación corporal, al conducir fácilmente el calor y por tanto iguala con rapidez la temperatura de todos los sectores del medio interno y de las células.
• Capilaridad: la acción capilar es la elevación espontánea de un líquido dentro de un tubo angosto, Esta acción es resultado de las fuerzas de cohesión dentro del líquido y de las fuerzas de adhesión entre el líquido y las paredes del recipiente. Si las fuerzas entre el líquido y el recipiente son mayores que las que hay dentro del líquido del mismo, éste subirá por las paredes del recipiente.
• Constante dieléctrica: por tener moléculas polares las cuales se disponen alrededor de los grupos polares del soluto, es decir el soluto queda rodeado de moléculas de agua; este fenómeno se denomina solvatación iónica
4.- ¿Qué porcentaje de agua se encuentra en el organismo en relación con el peso total?
El organismo humano está constituido por una cantidad de agua varia del 60 al 80% de su peso corporal.
5.- ¿Qué es una solución?
Una solución es una mezcla homogénea de dos o más sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. En cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.
6.- Menciona las propiedades de las soluciones.
a) Su composición química es variable.
b) Las propiedades químicas de los componentes de una solución no se alteran.
c) Las propiedades físicas de la solución son diferentes a las del solvente puro: la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
7.- Que es la solubilidad
La solubilidad es la cantidad máxima de un soluto que puede disolverse en una cantidad dada de solvente a una determinada temperatura.
8.- Defina Molaridad (M)
La molaridad de una solución se define como la cantidad de soluto disuelto en moles por un litro de solución.
9.- ¿Que es la Molalidad (m)?
La principal ventaja de este método de medidarespecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está enfunción del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión. Es menos empleada que la molaridad pero igual de importante.
Para preparar soluciones de una determinada molalidad en un disolvente, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
La molalidad (m) es el número de moles de soluto por kilogramo de solvente.
10.- Defina fracción molar.
Se define como la relación entre las moles de un componente y las moles totales presentes en la solución.
Xsto + Xste = 1
11.- Que son las propiedades colegativas
Muchas de las propiedades de las disoluciones verdaderas se deducen del pequeño tamaño de las partículas dispersas. En general, forman disoluciones verdaderas las sustancias con un peso molecular inferior a 104 dalton. Algunas de estas propiedades son función de la naturaleza del soluto (color, sabor, densidad, viscosidad, conductividad eléctrica, etc.). Otras propiedades dependen del disolvente, aunque pueden ser modificadas por el soluto (tensión superficial, índice de refracción, viscosidad, etc.). Sin embargo, hay otras propiedades más universales que sólo dependen de la concentración del soluto y no de la naturaleza de sus moléculas. Estas son las llamadas propiedades coligativas.
Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.
Son función sólo del número de partículas y son resultado del mismo fenómeno: el efecto de las partículas de soluto sobre la presión de vapor del disolvente.
12.- Cuales son las propiedades colegativas
Entre las propiedades coligativas figuran el descenso de la presión de vapor, la elevación del punto de ebullición, el descenso del punto de congelación y la presión osmótica. Las medidas de estas propiedades en una disolución acuosa diluida de un soluto no ionizado, como la urea o la glucosa, pueden permitir determinar con precisión las masas moleculares relativas.
13.- ¿Que es la presión osmótica?
Es la propiedad coligativa más importante por sus aplicaciones biológicas, pero antes de entrar de lleno en el estudio de esta propiedad es necesario revisar los conceptos de difusión y de ósmosis. Difusión es el proceso mediante el cual las moléculas del soluto tienen a alcanzar una distribución homogénea en todo el espacio que les es accesible, lo que se alcanza al cabo de cierto tiempo En Biología es especialmente importante el fenómeno de difusión a través de membranas, ya que la presencia de las membranas biológicas condiciona el paso de disolvente y solutos en las estructuras celulares.
14.- ¿Menciona que estructuras celulares presentan sistemas de membranas?
- Membrana plasmática
- Retículo endoplasmático granular y liso
- Aparato de Golgi
- Lisosomas
- Peroxisomas
- Mitocondrias
- Plastos
- Vacuolas
- Envoltura nuclear
15.- ¿Cuáles son las principales funciones de las biomembranas?
- separación física entre compartimientos.
- transporte de sustancias, involucradas, por ejemplo, en el metabolismo.
- recepción de estímulos [hormonas, transmisión de impulsos nerviosos, etc.], y muchas veces también su reconocimiento.
- conducción de impulsos nerviosos.
- interacciones célula-célula.
16.- ¿Como esta constituida una membrana?
Las membranas funcionales están compuestas de lípidos y proteínas. Cierta porción glucídica detectable forma en realidad parte de las otras sustancias mencionadas, integrando glucoproteínas y glucolípidos. Los lípidos constituyen la matriz o base estructural. Las proporciones entre los distintos componentes es muy variable. Las proteínas forman la parte funcional de las membranas. La variedad es muy grande, de acuerdo a las muchas funciones que pueden desempeñar: receptores, transportadores para entrada y/o salida de sustancias, enzimas, antígenos de superficie, etc. La proporción entre lípidos y proteínas también es variable.
17.- Menciona las propiedades de la estructura del mosaico fluido.
a)- Fluidez: permite un movimiento muy libre tanto de lípidos como de proteínas, al menos dentro de cada una de las capas.
b)- Asimetría: la composición lipídica y la proteica [esta más aún] son diferentes entre ambas capas.
c)- Resistencia eléctrica: si a uno y otro lado de la membrana se hallan sendas soluciones con distinta carga neta, aquella es perfectamente apta para mantener la diferencia de potencial eléctrico que se produce, la cual se denomina potencia de membrana.
18.- En liste los diferentes tipos de transporte a través de la membrana
- Transporte activo
- Transporte pasivo
- Transporte pasivo simple
- Difusión facilitada
19.- Describa el transporte activo.
Cuando el transporte se realiza en contra de un gradiente químico (de concentración) o eléctrico. Para este tipo de transporte se precisan transportadores específicos instalados en la membrana, siempre proteínas, que, mediante un gasto de energía en forma de ATP, transportan sustancias a través de ésta. Con este tipo de transporte pueden transportarse, además de pequeñas partí culas, moléculas orgánicas de mayor tamaño, siempre en contra del gradiente de concentración o eléctrico.
20.- En que consiste la endocitosis
Las sustancias entran en la célula envueltas en vesículas formadas a partir de la membrana plasmática. Cuando lo que entra en la célula son partículas sólidas o pequeñas gotitas líquidas el transporte se realiza por mecanismos especiales e incluso se hace perceptible. Estos mecanismos implican una deformación de la membrana y la formación de vacuolas. Este tipo de transporte puede ser de gran importancia en ciertas células, como por ejemplo, en los macrófagos y en las amebas. Distinguiremos dos tipos de endocitosis: la fagocitosis y la pinocitosis.
miércoles, 24 de junio de 2009
Membranas plasmaticas
La estructura de todas las membranas biológicas es muy parecida. Las diferencias se establecen más bien al nivel de la función particular que tienen los distintos orgánulos formados por membranas; función que va a depender de la composición que tengan sus membranas. Este tipo de membranas se denomina, debido a esto, unidad de membrana o membrana unitaria. La
membrana plasmática de la célula y la de los orgánulos celulares está formada por membranas unitarias.
ORGÁNULOS Y OTRAS ESTRUCTURAS FORMADOS POR MEMBRANAS UNITARIAS
- Membrana plasmática
- Retículo endoplasmático granular y liso
- Aparato de Golgi
- Lisosomas
- Peroxisomas
- Mitocondrias
- Plastos
- Vacuolas
- Envoltura nuclear

Ciertos lípidos, y en particular los fosfolípidos, tienen una parte de la molécula que es polar: hidrófila y otra (la correspondiente a las cadenas hidrocarbonadas de los ácidos grasos) que es no polar: hidrófoba. Las moléculas que presentan estas características reciben el nombre de anfipáticas. A partir de ahora representaremos la parte polar (hidrófila) y la no polar (hidrófoba) de los lípidos anfipáticos.
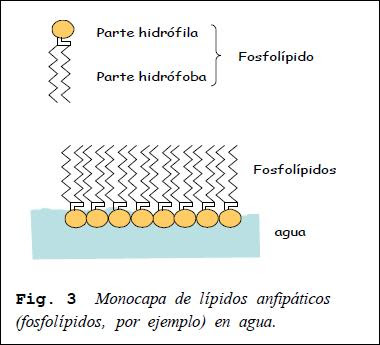
FORMACIÓN DE BICAPAS LIPÍDICAS
Si se dispersa por una superficie acuosa una pequeña cantidad de un lípido anfipático, se puede formar una capa de una molécula de espesor: monocapa. Esto es debido a que las partes hidrófilas se disponen hacia el interior y los grupos hidrófobos hacia el exterior de la superficie acuosa. Pueden también formarse bicapas, en particular entre dos compartimentos acuosos.
Entonces, las partes hidrófobas se disponen enfrentadas y las partes hidrófilas se colocan
hacia la solución acuosa. Los lípidos anfipáticos forman este tipo de estructuras espontáneamente. Las bicapas pueden formar compartimentos cerrados denominados
liposomas. Las bicapas lipídicas poseen características similares a las de las membranas
celulares: son permeables al agua pero impermeables a los cationes y aniones y a las grandes moléculas polares. En realidad, las membranas celulares son, esencialmente, bicapas lipídicas.
FUNCIONES
sumamente abundantes: en células eucarióticas pueden alcanzar hasta un 80% del peso
seco.
Principales funciones:
a]- separación física entre compartimientos
b]- transporte de sustancias, involucradas, por ejemplo, en el metabolismo
c]- recepción de estímulos [hormonas, transmisión de impulsos nerviosos, etc.], y
muchas veces también su reconocimiento
d]- conducción de impulsos nerviosos
e]- interacciones célula-célula
Los fosfolípidos tienden a agruparse espontáneamente en micelas. Son pequeñas aglomeraciones esferoidales donde las colas, apolares, se dirigen todas hacia el centro, libre de agua, y las cabezas, polares se orientan hacia la periferia, ofreciendo una superficie afín con el agua. El interior de estos esferoides es hidrofóbico, mientras que su exterior es hidrofílico, de acuerdo al comportamiento dual [antipático] de este tipo de lípidos.
cabeza
polar
cola
no polar
COMPOSICIÓN DE LAS BIOMEMBRANAS
glucídica detectable forma en realidad parte de las otras sustancias mencionadas, integrando glucoproteínas y glucolípidos. Los lípidos constituyen la matriz o base estructural. Las proporciones entre los distintos componentes es muy variable. Las proteínas forman la parte funcional de las biomembranas. La variedad es muy grande, de acuerdo a las muchas funciones que pueden desempeñar: receptores, transportadores para entrada y/o salida de sustancias, enzimas, antígenos de superficie, etc. La proporción entre lípidos y proteínas también es variable.
La bicapa lipídica es la matriz en la cual las moléculas proteicas son como islas. Esta estructura recibe el nombre de mosaico fluido, pues la matriz posee baja viscosidad y las proteínas pueden ser consideradas semejantes a trozos de piedras dispersos en un mosaico. Dichas moléculas de proteínas se encuentran más o menos inmersas en la matriz lipídica, proteínas intrínsecas o integradas; o bien como solamente apoyadas sobre las cabezas de los fosfolípidos [son mantenidas por interacciones electrostáticas], a ambos lados de la membrana, proteínas extrínsecas o periféricas. La posición que ocupa una proteína determinada en la matriz depende siempre de interacciones de los grupos laterales de ciertos restos de aminoácidos componentes con las moléculas lipídicas.

b)- Asimetría: la composición lipídica y la proteica [esta más aún] son diferentes entre ambas capas.
c)- Resistencia eléctrica: si a uno y otro lado de la membrana se hallan sendas soluciones con distinta carga neta, aquella es perfectamente apta para mantener la diferencia de potencial eléctrico que se produce, la cual se denomina potencia de membrana.
TRANSPORTE DE SUSTANCIAS A TRAVÉS DE LA MEMBRANA PLASMÁTICA
La célula necesita sustancias para su metabolismo. Como consecuencia de éste se van a producir sustancias de desecho que la célula precisa eliminar. Así pues, a través de la membrana plasmática se va a dar un continuo transporte de sustancias en ambos sentidos. Según la dirección de este y el tipo de sustancia tendremos:
- Ingestión:Es la entrada en la célula de aquellas sustancias necesarias para su
metabolismo.
- Excreción: Salida de los productos de desecho.
- Secreción: Si lo que sale no son productos de desecho sino sustancias
destinadas a la exportación.
Mediante estos fenómenos la célula asegura un medio interno diferente y funciones distintas en cada uno de los orgánulos formados por membranas.
A)EL TRANSPORTE DE SUSTANCIAS EN FORMA MOLECULAR A TRAVÉS DE LAS MEMBRANAS
En el caso de sustancias disueltas, según se consuma o no energía, distinguiremos los siguientes tipos de transporte:

a) Transporte pasivo simple o difusión de moléculas a favor del gradiente.
i) Difusión a través de la bicapa lipídica. Pasan así sustancias lipìdicas como las hormonas
esteroideas, los fármacos liposolubles y los anestésicos, como el éter. También sustancias apolares como el oxígeno y el nitrógeno atmosférico y algunas moléculas polares muy
pequeñas como el agua, el CO2, el etanol y la glicerina.
ii) Difusión a través de canales protéicos. Se realiza a través de proteínas canal. Proteínas que
forman canales acuosos en la doble capa lipídica. Pasan así ciertos iones, como el Na+ , el K+ y el Ca+ + .

b) Transporte pasivo facilitado (difusión facilitada). Las moléculas hidrófilas (glúcidos,
aminoácidos...) no pueden atravesar la doble capa lipídica por difusión a favor del
gradiente de concentración. Determinadas proteínas de la membrana, llamadas
permeasas, actúan como "barcas" para que estas sustancias puedan salvar el obstáculo
que supone la doble capa lipídi ca. Este tipo de transporte tampoco requiere un consumo
de energía, pues se realiza a favor del gradiente de concentración.

II)Transporte activo: Cuando el transporte se realiza en contra de un gradiente quími co
(de concentración) o eléctrico. Para este tipo de transporte se precisan transportadores específi cos instalados en la membrana, siempre proteí nas, que, mediante un gasto de energía en forma de ATP, transportan sustancias a través de ésta. Con este tipo de transporte pueden transportarse, además de pequeñas partí culas, moléculas orgánicas de mayor tamaño, siempre en contra del gradiente de concentración o eléctrico.

B) Tranporte químico
ejemplo: amebas, macrófagos o las células del epitelio intestinal.
partir de la membrana plasmática. Cuando lo que entra en la célula son partículas sólidas o pequeñas gotitas líquidas el transporte se realiza por mecanismos especiales e incluso se hace perceptible. Estos mecanismos implican una deformación de la membrana y la formación de vacuolas. Este tipo de transporte puede ser de gran importancia en ciertas células, como por
ejemplo, en los macrófagos y en las amebas. Distinguiremos dos tipos de endocitosis:
la fagocitosis y la pinocitosis

por medio de seudópodos. Los seudópodos son grandes evaginaciones de la
membrana plasmática que envuelven a la partí cula. Ésta pasa al citoplasma de la célula en forma de vacuola fagocítica. Este tipo de ingestión la encontramos, por ejemplo, en las amebas o en los macrófagos.

líquidas que atraviesan la membrana al invaginarse ésta. Se forman así pequeñas
vacuolas llamadas vacuolas pinocíticas que pueden reunirse formando vacuolas de
mayor tamaño.

vesículas de exocitosis, que se fusionan con la membrana plasmática abriéndose al
exterior y expulsando su contenido. Las vacuolas provienen de los sistemas de membranas o de la endocitosis. La membrana de la vacuola queda incluida en la membrana celular, lo que es normal teniendo en cuenta que ambas membranas poseen la misma estructura.
En todos los mecanismos de endocitosis hay una disminución de la membrana plasmática al introducirse ésta en el citoplasma. Esta disminución es compensada por la formación de membranas por exocitosis. La membrana plasmática está en estas células en un continuo proceso de renovación. En un macrófago, por ejemplo, toda su membrana es ingerida en 30 min.

miércoles, 17 de junio de 2009
Propiedades coligativas
Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.
Son función sólo del número de partículas y son resultado del mismo fenómeno: el efecto de las partículas de soluto sobre la presión de vapor del disolvente.

PRESION DE VAPOR
La presión de vapor de un liquido depende de la facilidad con la cual las moléculas pueden
escapar de la superficie del mismo.
La relación entre la presión de vapor de la disolución y la del solvente esta dada por la
siguiente relación, conocida como “ LEY DE RAOULT “.

ELEVACIÓN DEL PUNTO DE EBULLICIÓN ( soluto no volátil y no disociable)
El punto de ebullición de una disolución es la temperatura a la cual su presión de vapor iguala
la presión atmosférica.
Kb = Constante de elevación del punto de ebullición o constante ebulloscópica. Depende del
solvente y su valor se encuentra
DISMINUCIÓN DEL PUNTO DE CONGELACIÓN
Cuando se agrega un soluto no volátil a un solvente puro, el punto de congelación de éste disminuye.
Pto. Cong. solución < Pto. Cong. solvente puro
PRESIÓN OSMÓTICA
Es la propiedad coligativa más importante por sus aplicaciones biológicas, pero antes de entrar de lleno en el estudio de esta propiedad es necesario revisar los conceptos de difusión y de ósmosis.
Difusión es el proceso mediante el cual las moléculas del soluto tienen a alcanzar una distribución homogénea en todo el espacio que les es accesible, lo que se alcanza al cabo de cierto tiempo En Biología es especialmente importante el fenómeno de difusión a través de membranas, ya que la presencia de las membranas biológicas condiciona el paso de disolvente y solutos en las estructuras celulares

La presión osmótica (π) de una disolución es la presión que se requiere para detener la
osmosis del disolvente puro hacía una disolución. La presión osmótica de una disolución esta
dada por:
miércoles, 3 de junio de 2009
Soluciones
Una solución es una mezcla homogénea de dos o mas sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. en cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.
La concentración de una solución expresa la relación de la cantidad de soluto a la cantidad de solvente.
Las soluciones poseen una serie de propiedades que las caracterizan :
1. Su composición química es variable.
2. Las propiedades químicas de los componentes de una solución no se alteran.
3. Las propiedades físicas de la solución son diferentes a las del solvente puro : la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
PRINCIPALES CLASES DE SOLUCIONES

SOLUBILIDAD
La solubilidad es la cantidad máxima de un soluto que puede disolverse en una cantidad dada de solvente a una determinada temperatura.
Los factores que afectan la solubilidad son:
- a) Superficie de contacto: La interacción soluto-solvente aumenta cuando hay mayor superficie de contacto y el cuerpo se disuelve con más rapidez ( pulverizando el soluto).
- b) Agitación: Al agitar la solución se van separando las capas de disolución que se forman del soluto y nuevas moléculas del solvente continúan la disolución
- c) Temperatura: Al aument6ar la temperatura se favorece el movimiento de las moléculas y hace que la energía de las partículas del sólido sea alta y puedan abandonar su superficie disolviéndose.
- d) Presión: Esta influye en la solubilidad de gases y es directamente proporcional
MODO DE EXPRESAR LAS CONCENTRACIONES
La concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. Los términos diluida o concentrada expresan concentraciones relativas. Para expresar con exactitud la concentración de las soluciones se usan sistemas como los siguientes:
Porcentual
- a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.
- b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
- c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
Molaridad
Este método es muy útil para expresar concentraciones cuando se utiliza equipo volumétrico tales como probetas, buretas o pipetas, sólo se necesita pesar cierta cantidad de soluto que corresponda a la concentración deseada y se adiciona suficiente disolvente hasta completar un
volumen determinado en un matraz volumétrico aforado.
La molaridad de una solución se define como la cantidad de soluto disuelto en moles por litro de solución.
Molalidad
La principal ventaja de este método de medidarespecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de lapresión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está enfunción del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión. Es menos empleada que la molaridad pero igual de importante.
Para preparar soluciones de una determinada molalidad en un disolvente, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
La molalidad (m) es el número de moles de soluto por kilogramo de solvente.

Fracción molar (Xi)
Se define como la relación entre las moles de un componente y las moles totales presentes en la solución.
Xsto + Xste = 1
Bibliografía
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/soluciones.htm
http://www.scribd.com/doc/13763538/UNIDADESQUIMICAS1?autodown=pdf
miércoles, 27 de mayo de 2009
Agua
La estructura de la molécula de agua esta formada por 2 átomos de hidrogeno y un átomo de oxígeno que se mantienen unidos por enlaces covalentes (se forma cuando 2 átomos comparten electrones, el cual es un enlace muy fuerte).

El agua es una molécula polar ya que tiene partes o áreas con propiedades contrastantes u opuestas, como cargas positivas y cargas negativas; de las cuales formarán enlaces débiles.

Estos enlaces, en los que se unen un átomo de hidrógeno con carga positiva débil que forma parte de otra molécula, con un átomo de oxígeno (ó N ó F) que posé una carga negativa débil y que pertenece a otra molécula, se le conoce como “puente de hidrogeno” o “enlace de hidrogeno”.

Los puentes de hidrogeno determinan muchas propiedades del agua como son:
- Calor específico: el agua contribuye a estabilizar la temperatura del organismo en función de su elevado calor específico.
- Cohesión: fuerza implicada en mantener la unión de moléculas de la misma sustancia.
- Tensión superficial: resistencia a la penetración de la superficie de un líquido causado por la cohesión de sus moléculas (como por ejemplo el mercurio). Ayuda para el transporte del agua.
- Conductividad térmica: el agua influye en la termorregulación corporal, al conducir fácilmente el calor y por tanto iguala con rapidez la temperatura de todos los sectores del medio interno y de las células.
- Capilaridad: la acción capilar es la elevación espontánea de un liquido dentro de un tubo angosto, Esta acción es resultado de las fuerzas de cohesión dentro del líquido y de las fuerzas de adhesión entre el líquido y las paredes del recipiente. Si las fuerzas entre el líquido y el recipiente son mayores que las que hay dentro del líquido del mismo, éste subirá por las paredes del recipiente.
- Constante dieléctrica: por tener moléculas polares las cuales se disponen alrededor de los grupos polares del soluto, es decir el soluto queda rodeado de moléculas de agua; este fenómeno se denomina solvatación iónica.

BIBLIOGRAFÍA
Hein Morris. (1997), Fundamentos de Química. International Thomson Editores, México, pp 289-299.




